La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
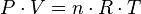
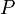 = Presión.
= Presión. = Volumen.
= Volumen.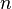 = Moles de Gas.
= Moles de Gas.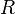 = Constante universal de los gases ideales.
= Constante universal de los gases ideales.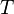 = Temperatura absoluta.
= Temperatura absoluta.
Los gases ideales, son gases hipotéticos, que no existen en la realidad y nos simplifican las operaciones.
Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.Algunas características de los gases ideales son:
1ºUn gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de éste.
2ºLos choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
3ºNo se tienen en cuenta las interacciones de atracción y repulsión molecular.
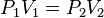
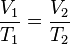




khe wen aporte a la comunidad
ResponderEliminarPiedad Bermudez gracias por tu aporte
ResponderEliminarMuy bonito tu comentario,saludos.
ResponderEliminarhttps://anifeeling.blogspot.com/2019/09/fire-force-o-me-quemome-quemo.html
https://anifeeling.blogspot.com/2019/09/kenja-no-mago-tu-quieres-un-mango.html
https://anifeeling.blogspot.com/2019/09/love-lab-una-comediashoujo-si-yo-se-que.html
azur-lane-revision-las-extraordinarias
arifureta-shokugyou-de-sekai-saikyou-un
assassins-pride-review
recopilación serie acción anime
El concepto de gas ideal es una herramienta teórica fascinante que nos permite comprender y predecir el comportamiento de los gases de forma sencilla y eficaz. Aunque sabemos que en la realidad no existen gases que cumplan al 100% estas condiciones, el modelo es sumamente útil porque simplifica los cálculos y nos ofrece una base sólida para el estudio de la termodinámica. Gracias a él, podemos explicar fenómenos cotidianos y realizar predicciones en procesos industriales, científicos o incluso meteorológicos. Saber que los gases reales se aproximan al comportamiento ideal en ciertas condiciones, como baja presión y alta temperatura, nos permite usar este modelo con criterio y eficiencia. En definitiva, el gas ideal es un ejemplo de cómo la ciencia construye modelos para entender el mundo, aunque estos modelos no siempre reflejen fielmente la realidad.
ResponderEliminar______________
Trabajo en la instalación de gas natural | Naturgy Contigo