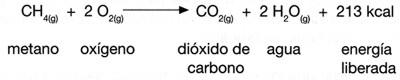
Cuando se produce una reacción química, no solo hay una transformación de una sustancia a otra, sino que también ocurre un cambio energético.
Siempre que se da una reacción química se produce un intercambio de energía entre los reactivos, los productos y el medio ambiente.
Este calor se mide en Julios según el Sistema internacional. Aunque normalmente usamos la Kilocaloría (Kcal) definida como la cantidad de calor necesaria para elevar 1ºC la temperatura de un gramo de agua.
Además, podemos igualar las dos unidades con la siguiente igualdad:
* 1Kcal - 4.184 Kj o más reducido aún * 1 cal - 4,184 julios
Antes de seguir con las reacciones endotérmicas y exotérmicas, hay que ver otro concepto: LA ENTALPIA.
La entalpía no es más que el calor que se absorbe o desprende en una reacción. Pero hay un problema, la entalpía no se puede medir directamente, por tanto, para saber cuanto es la entalpía debemos: Al calor de los productos Hp debemos restarles el calor de los reactivos Hr, y se simboliza con la diferencia de calores de las reacciones:




 A partir del descubrimiento de los rayos catódicos J.J. Thomson llegó a la conclusión de que las partículas de los rayos catódicos debían de ser partículas constituyentes fundamentales de toda la materia.
A partir del descubrimiento de los rayos catódicos J.J. Thomson llegó a la conclusión de que las partículas de los rayos catódicos debían de ser partículas constituyentes fundamentales de toda la materia.


