Medio básico
En medio básico se agregan iones hidróxilo (aniones) (OH−) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
Ecuación sin balancear:
Separamos las semirreacciones en
- Oxidación:

- Reducción:
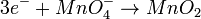
Agregamos la cantidad adecuada de Hidróxidos y Agua (las moléculas de agua se sitúan en donde hay mayor cantidad de oxígenos).
- Oxidación:

- Reducción:

Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.
- Oxidación:

- Reducción:

Obtenemos:
- Oxidación:

- Reducción:

Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.

 .
.- Fuente Wikipedia.





muchas gracias!!! ayer me pidieron hacer una clase para hoy sobre redox y eso lo pase en 1°... AHORA VOY EN 5° Y CASI NO ME ACORDABA!!! ajajjaja
ResponderEliminarEste comentario ha sido eliminado por un administrador del blog.
ResponderEliminarMuchas gracias, me apunto como seguidor de vuestro blog, seguramente me ayudara en química.
ResponderEliminarGracias me sirvio demaciado como el de medio acido y basico.
ResponderEliminarMUCHAS GRACIAS. EXPLICACIÓN MUY CLara
ResponderEliminaruna pregunta que paso con 4H2O Y 3H2O??
ResponderEliminarSe simplifican
EliminarMuy buena explicacion
ResponderEliminarEste tema es clave para entender no solo los ejercicios académicos, sino también aplicaciones prácticas como los procesos industriales, las pilas y baterías, e incluso algunos tratamientos ambientales. Reflexionar sobre esto nos hace valorar cómo los detalles de la química son fundamentales para controlar y optimizar procesos que impactan nuestra vida diaria, y resalta la importancia de tener bases sólidas en estos conceptos para poder aplicarlos de manera efectiva.
ResponderEliminar__________
Visita mi blog de aguas subterraneas.